
本文于医药观澜官方微信
以PD-1/PD-L1抑制剂为代表的免疫疗法是人类抗击癌症路上的一个里程碑,它们的到来使许多癌症患者的生活得到了改善。然而,这类疗法也有其局限性。例如,患者应答率有限,耐药后会出现,难以突破“冷肿瘤”等等。为了攻克这些挑战,许多公司纷纷踏上探索开发新一代肿瘤免疫疗法的征程,科望医药就是其中备受瞩目的一家公司。
科望医药成立于2017年7月,由纪晓辉博士和卢宏韬博士联合创立。“科望=科学+希望。我们希望凭借对免疫系统精妙调控网络的独到认识和理解,发现、解决免疫系统中的关键问题,开发出新一代、差异化的肿瘤免疫疗法,为全球癌症患者,尤其是为对PD-1/PD-L1抑制剂无应答的癌症患者提供新型且有效的治疗选择。”卢宏韬博士介绍道。
成立四年来,科望医药取得一系列阶段性进展。目前,该公司已建立一条包含9款新型免疫疗法的产品管线,其中4款已进入临床研究阶段。尤其引人关注的是,在科望医药的研发管线中,绝大部分为其自主研发的“全球新”创新药,包括抗CD39单抗、抗SIPRα单抗等一些尚未有同靶点药物获批、且只有少数企业在开发的药物。
在众多的肿瘤免疫靶点中,科望医药为何独辟蹊径,开发一些相对“冷门”靶点?这些新一代肿瘤免疫疗法有何独特之处?又有哪些治疗前景?带着这些疑问,药明康德内容团队于近日采访了科望医药联合创始人、科学官卢宏韬博士。
“不走寻常路”
时间拉回到四年前。当时,全球范围内已有几款PD-1/PD-L1抑制剂、CTLA-4抑制剂获批,它们在肿瘤治疗中展现出的疗效和潜力吸引了众多生物医药公司的加入。在肿瘤免疫治疗领域,刚成立的科望医药如何切入,解决现有疗法未能触及的医学痛点?科望医药的创始团队对此有着清晰的认识和定位。
虽然PD-1/PD-L1免疫检查点抑制剂在癌症治疗中取得了成功,但遗憾的是,只有约10%-30%的实体肿瘤患者对这类疗法的单药治疗有反应,大部分的肿瘤患者并不能从中获益。科学研究认为,一些肿瘤对PD-1/PD-L1抑制剂没反应主要因为它们是“冷肿瘤”。所谓“冷肿瘤”是指肿瘤微环境里面没有T细胞,或者T细胞的活性在肿瘤微环境里面被抑制,无法发挥抗肿瘤效果。科望医药想要攻克这一难题。
“我们的策略是从人体的先天性免疫(又称‘固有免疫’)和适应性免疫系统出发,并重点关注先天性免疫和肿瘤微环境调控,通过‘解除免疫抑制因子’和‘重新激活衰竭的T细胞’两个研发策略,开发出更有效的新一代肿瘤免疫治疗药物,为其余的70%-90%的肿瘤患者带来治疗选择。”卢宏韬博士介绍道。
科望医药自主研发的候选药物为靶向ATP-腺苷通路中CD39的单克隆抗体。研究发现,肿瘤之所以难以被攻克,一大关键在于它们会形成抑制免疫攻击的“微环境”。肿瘤微环境(TME)就像一把保护伞,让诸如PD-1/PD-L1抑制剂之类的免疫疗法对肿瘤无可奈何。ATP-腺苷通路就是肿瘤微环境中先天性免疫和适应性免疫的关键调节剂,它在CD39和CD73两种水解酶的协同作用下,将细胞外ATP(eATP)转化为腺苷,进而抑制免疫反应。因此,通过抑制CD39或CD73的活性,就有望解除这种免疫抑制,恢复免疫细胞对癌细胞的杀伤力。
既然两个靶点都具有开发潜力,科望医药为何选择CD39,而不是CD73呢?卢宏韬博士解释道,虽然抑制这两个靶点中的任何一个都可以抑制腺苷的产生,但抑制CD39有一些独特的优势:“一方面,阻断CD39有望显著增加ATP介导的IL-1ß和IL-18释放,它们是抗肿瘤中的重要细胞因子,抗CD73抗体没有这种效果;另一方面,在肿瘤微环境里面,CD39会在调节性T细胞(Treg细胞)中高表达,而CD73在Treg细胞中基本不表达,这意味着阻断CD39也会抑制Treg细胞的功能,进而增强效应T细胞对癌细胞的杀伤力。”
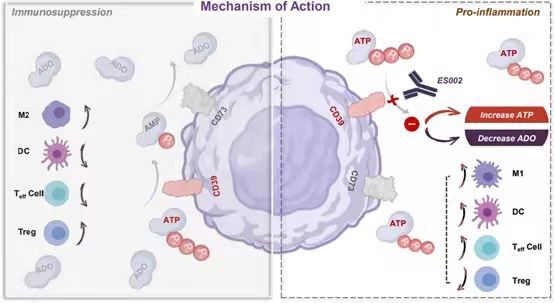
▲抗CD39抗体ES002的作用机制(图片来源:科望医药提供)
2021年9月,科望医药开发的抗CD39抗体药物ES002的新药临床试验申请(IND)获得美国FDA批准。这是一项1期临床试验,旨在评估ES002在晚期实体瘤患者中的安全性和耐受性,药代动力学和药效动力学,并初步探索其抗肿瘤活性。据介绍,ES002是全球第四款、中国公司中首款进入临床研究阶段的抗CD39抗体。在后续的研究中,科望医药将会探索ES002单药,以及其与PD-1抑制剂、化疗等联合治疗一些“冷肿瘤”的效果,包括部分非小细胞肺癌、胃癌等。近期内,科望医药也将在中国提交ES002的IND申请。
在ES002的基础上,为更有效地解除肿瘤微环境内的抑制因子,科望医药还开发了一款靶向CD39和TGFβ的双特异抗体ES014。据卢宏韬博士介绍:“ES014是世界上针对这两个靶点的双特异性抗体,这样的设计主要出于两方面的考虑:一方面,TGFβ是肿瘤微环境里面另一个重要的抑制通路,研究显示TGFβ在多种实体瘤中高表达,并通过抑制T细胞浸润等多种机制产生免疫抑制性的肿瘤微环境;另一方面,通过靶向CD39高表达的Treg等免疫细胞,ES014可在肿瘤组织中相对蓄积更多,并同时抑制腺苷和TGFβ这两个信号通路,进一步增强免疫细胞的功能。”
ES014是通过将TGF-β受体融合到靶向CD39的抗体上设计而成的双功能分子,它不仅可以抑制免疫抑制性腺苷的生成,促进免疫刺激性ATP的生成,而且还能通过中和免疫抑制因子TGF-β,创造有利免疫反应的肿瘤微环境。已有研究表明,ES014能够有效阻断Treg细胞的分化,促进效应T细胞的存活和功能。在对PD-1抑制剂无反应的小鼠模型中,ES014展现了很好的单药抗肿瘤疗效。据悉,在2021年11月即将举行的第36届癌症免疫治疗学会(SITC)年会上,科望医药将首次公布ES014的研究成果。
“另辟蹊径”,开发抗SIPRα抗体
众所周知,人体的免疫系统包括先天性免疫和适应性免疫。无论是PD-1/PD-L1抑制剂,还是抗CTLA-4抗体等免疫检查点抑制剂类药物,都是围绕着T细胞相关的适应性免疫来开发。在科望医药看来,在开发抗新一代的肿瘤免疫疗法上,先天性免疫调节为下一个突破口。
“在人体的免疫系统中,先天性免疫是道防线,不仅直接参与杀伤肿瘤,而且还在激活适应性免疫系统中扮演着重要的角色。尤其是在将‘冷肿瘤’变成‘热肿瘤’的过程中,先天性免疫起着关键的作用。”卢宏韬博士表示,“科望成立以来,我们已经在先天性免疫系统的重要组成部分巨噬细胞方面开展了大量的研究,并取得了可喜的成果。”
ES004是科望医药基于巨噬细胞中的“别吃我”信号通路自主研发的一款创新药物,它是一款靶向CD47-SIRPα信号通路的抗体。在人体内,巨噬细胞能够区分“敌我”,在消灭病原体和异常细胞的同时,不伤害正常细胞,这一机制主要依赖于人体正常细胞表面表达的CD47蛋白。CD47通过与巨噬细胞表面的信号调节蛋白SIRPα结合,传递“别吃我”的信号,从而使正常细胞免被“误伤”。然而,研究发现,狡猾地癌细胞也会通过高表达CD47来逃脱巨噬细胞的吞噬。因此,开发靶向CD47的抗体或抗SIRPα抗体有望阻断CD47-SIRPα通路,进而刺激巨噬细胞的吞噬功能,引发适应性免疫应答,激活T细胞杀伤,增强免疫应答。
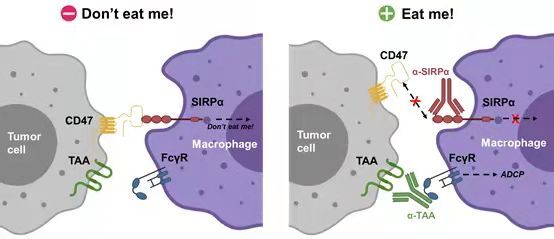
▲CD47-SIRPα信号通路(图片来源:科望医药提供)
不过,与很多企业选择开发靶向CD47的抗体不同,科望医药ES004的靶点是CD47的受体SIRPα。这一与众不同的选择又是出于什么样的考量呢?
“由于CD47蛋白广泛表达于红细胞、血小板等正常细胞表面,靶向CD47抗体易引起CD47抗原沉默、红细胞凝集、血小板减少、中性粒细胞减少等不良反应。而且,抗CD47抗体目前仅在血液癌症中看到疗效,在实体瘤领域取得的进展还非常有限。因此,科望医药决定从另一个角度出发,开发靶向CD47受体SIRPα的免疫疗法。”卢宏韬博士说到。
据卢宏韬博士介绍,与抗CD47抗体相比,靶向SIRPα的抗体有一些潜在优势:“不像CD47在很多细胞中都有表达,SIRPα只在髓性细胞,比如巨噬细胞上表达,所以用小剂量的SIRPα抗体就足以阻断肿瘤细胞的CD47-SIRPα通路;其次,SIRPα不在红细胞表达,不会造成红细胞减少等不良反应,治疗窗要更广;后,抗SIRPα抗体可以通过结合外周单核细胞更容易进入到充满巨噬细胞的实体肿瘤微环境,预计对实体瘤治疗会有突出的意义。”
目前,科望医药的抗SIRPα抗体ES004已在临床前研究中表现出了潜力。卢宏韬博士进一步介绍道,“ES004对各SIRPα变体均具有超强的亲和力、可高效阻断CD47-SIRPα通路、具有独特的抗原结合表位和出色的巨噬细胞吞噬诱导功能。而且ES004与抗肿瘤相关抗原(TAA)抗体有较强的协同抗肿瘤疗效、且不阻碍T细胞功能、在临床前实验中显示出良好的安全性和可成药性。”
值得一提的是,科望医药在巨噬细胞调节上有着系统性的研发策略。比如,他们利用独特的巨噬细胞激活抗体,开发出了巨噬细胞肿瘤交联平台,简称BiME(Bispecific Macrophage Engager)。据悉,BiME利用靶向SIRPα的阻断型抗体作为巨噬细胞衔接器和激活剂,将其与抗TAA抗体连接,可直接激活巨噬细胞对该特定TAA肿瘤的吞噬作用。在此平台上,科望医药开发出了一系列发挥巨噬细胞活性的双特异抗体药物,其中一款是可同时靶向SIRPα和CLDN18.2的双特异性抗体ES028。在2021年11月即将举行的第36届癌症免疫治疗学会年会上,科望医药将首次公布BiME和ES028的研究成果。
未来两年,将有5款自主研发新药申报IND
经过四年的发展,科望医药已进入到了快速发展期。除了上述自主研发新药外,该公司还建立了三个技术平台:肿瘤免疫体外药效筛选平台Immunoshine、双抗设计平台AbLego和巨噬细胞肿瘤交联平台BiME。
“‘工欲善其事,必先利其器’,基于这些技术平台,我们可以持续、高效地开发创新候选药物,实现‘科望智造,一年一分子’的目标,每年至少将一个具有全球创新性的候选药物推进到临床阶段。”卢宏韬博士表示。
除了上述几款自主开发的产品,科望医药还有几款引进的产品已进入到临床阶段。据卢宏韬博士介绍,在接下来的2年内,科望医药的四款候选药物ES101(4-1BB/PD-L1双特异性抗体)、ES102(OX40激动剂抗体)、ES104(VEGF/Dll4双特异性抗体)、ES002(抗CD39抗体)将会公布各阶段的临床试验数据。同时,该公司有5款自主研发的创新药将会在未来两年内在美国和中国申报IND,包括CD39/TGFβ双特异抗体、抗SIRPα单抗、SIRPα/CLDN18.2双特异性抗体等等。
用卢宏韬博士的话说,科望医药会以持续创新作为公司发展的动力,永远不会“随波逐流”。他们会利用自己独特的优势和差异化的研发策略,探索肿瘤免疫学中仍未被破解的奥秘,尽快将突破性生命科学研究转化为造福肿瘤患者的创新药物,从而真正兑现人们对科学寄予的厚望。
企业传播:
PR@elpiscience.com
